Badania prowadzone w Zakładzie Embriologii UW
Regulacja struktury i funkcji heterochromatyny okołocentromerowej we wczesnym rozwoju zarodkowym myszy
Kierownikiem projektu jest dr hab. Ewa Borsuk, prof. uczelni. Udział w projekcie jest dostępny dla licencjuszy i magistrantów Zakładu Embriologii.
Celem projektu jest zbadanie roli fosforylacji seryny 10 histonu H3 oraz niehistonowego białka HP1 (ang. heterochromatin protein 1) w regulacji struktury heterochromatyny okołocentromerowej w przedimplantacyjnym rozwoju zarodka myszy.
Zmiany strukturalne chromatyny są możliwe między innymi dzięki obecności białek histonowych tworzących rdzeń nukleosomu. Modyfikacje post-translacyjne N-końcowych domen histonów rdzeniowych mogą być odpowiedzialne za regulację ekspresji informacji genetycznej, replikację DNA, kondensację chromosomów i ich rozdział do komórek potomnych, i wiele innych procesów. Niektóre pełnią dodatkowo rolę znacznika molekularnego dla niehistonowych białek, które również wpływają na strukturę chromatyny. Takim białkiem jest HP1, które preferencyjnie łączy się z metylowaną lizyną 9 histonu H3. W komórkach somatycznych jego dwie izoformy (HP1α i HP1β) są niezbędne dla utrzymania struktury i prawidłowego funkcjonowania domen heterochromatyny okołocentromerowej. Podczas zapłodnienia i rozwoju zarodkowego myszy i innych ssaków zachodzą liczne zmiany struktury chromatyny, charakterystyczne dla konkretnych etapów i niezbędne dla dalszego prawidłowego rozwoju. Niektóre zjawiska typowe dla heterochromatyny okołocentromerowej np. formowanie chromocentrów, czy wiązanie i usuwanie niektórych białek, odbywają się we wczesnych zarodkach myszy nieco inaczej niż komórkach somatycznych. W prowadzonych przez nas badaniach zajmujemy się rolą fosforylacji seryny 10 histonu H3 (H3S10) w regulacji struktury heterochromatyny okołocentromerowej i ekspresji genów we wczesnych zarodkach myszy. Chcemy sprawdzić czy hamowanie fosforylacji H3S10 w I cyklu komórkowym wpływa na formowanie chromocentrów, ekspresję wczesnych genów zarodkowych i dalszy, przedimplantacyjny rozwój zarodka. Zajmujemy się również analizą występowania i funkcją białek HP1 podczas formowania heterochromatyny okołocentromerowej.
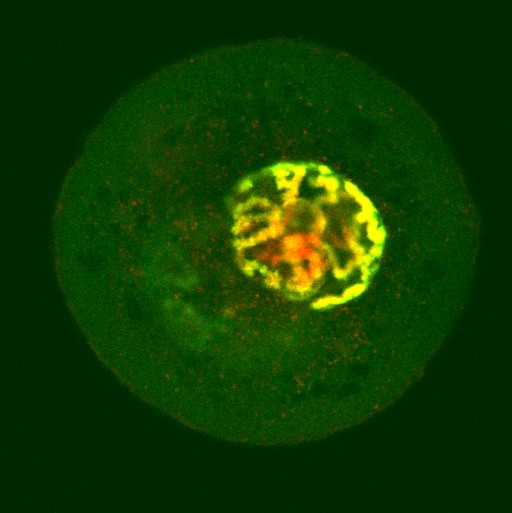
Fosforylacja seryny 10 histonu H3 w profazie i prometafazie I podziału bruzdkowania zarodka myszy. Chromatyna barwiona jodkiem propidyny (czerwona), przeciwciało na fosforylowaną serynę związane z FITC (zielone).
Rola białek kompleksów pre-replikacyjnych w regulacji podziałów mejotycznych i mitotycznych w zarodkach myszy
Kierownikiem projektu jest dr hab. Ewa Borsuk, prof. ucz. Udział w projekcie jest dostępny dla licencjuszy i magistrantów Zakładu Embriologii.
We wszystkich komórkach eukariotycznych rozpoczęcie fazy S musi być poprzedzone tworzeniem kompleksów pre-replikacyjnych (pre-RC) w miejscach inicjacji replikacji. Rola białek wchodzących w ich skład, w inicjacji syntezy DNA została stosunkowo dobrze zbadana. W ostatnich latach pojawiły się prace wskazujące, że przynajmniej niektóre z nich pełnią w komórce również inne funkcje, niezwiązane z replikacją. Sugeruje się m.in., że białka kompleksu ORC (ang. Origin Recognition Complex) uczestniczą w procesie wyciszania aktywności transkrypcyjnej i formowania heterochromatyny w komórkach Drosophila i człowieka, a także w organizacji kinetochorów i segregacji chromosomów w mitozie. Podobnie białko Cdc6 (ang. Cell division cycle 6) w komórkach somatycznych bierze udział w segregacji chromosomów i inaktywowaniu kinazy CDK1, katalitycznej podjednostki MPFu. Funkcja białek kompleksów pre-RC w oocytach i komórkach zarodkowych ssaków jest znacznie słabiej poznana. Celem projektu jest analiza występowania i roli białek uczestniczących w formowaniu kompleksów pre-RC (np. Orc2, Cdc6) w regulacji podziałów mejotycznych (dojrzewanie oocytu) i pierwszych mitoz zarodkowych.
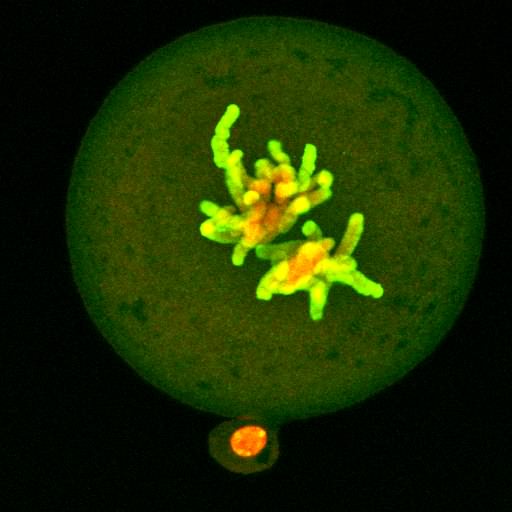
 | Białko Cdc6 na chromosomach metafazy II podziału mejotycznego oocytu myszy. Chromatyna barwiona jodkiem propidyny (czerwona), przeciwciało na Cdc6 związane z FITC (zielone). |
Mechanizmy wyodrębniania się komórek trofektodermy oraz węzła zarodkowego, a następnie hipoblastu i epiblastu w zarodkach myszy
Kierownik projektu: prof. dr hab. Marek Maleszewski. Udział w projekcie jest dostępny dla licencjuszy i magistrantów Zakładu Embriologii.
Celem badań proponowanych w tym projekcie jest bliższe poznanie mechanizmów molekularnych, które regulują pierwsze etapy różnicowania komórkowego w zarodku myszy: wykształcanie się trofektodermy (TE) i węzła zarodkowego (ICM) blastocysty, a następnie w obrębie węzła zarodkowego pierwotnej ektodermy (epiblastu – EPI) i endodermy (hipoblastu – PE). W szczególności chcemy zbadać:
- Jaki jest związek pomiędzy kompakcją zarodka 8-komórkowego, polaryzacją blastomerów, a ekspresją genu Cdx2 w komórkach zewnętrznych?
- Czy położenie wewnętrzne lub zewnętrzne blastomerów w zarodku jest jedynym czynnikiem decydującym o ekspresji genów, których produkty decydują o różnicowaniu się TE (Cdx2) i zachowaniu pluripotencji przez komórki ICM (Oct4)?
- W jaki sposób dochodzi do zróżnicowania komórek ICM na EPI i PE, jaka jest chronologia i topografia zmian w potencjale zewnętrznych komórek ICM do przekształcania się w TE, a następnie w PE?
Proponowane badania powinny wyjaśnić, jakie mechanizmy molekularne prowadzą do wyodrębnienia w przedimplantacyjnym zarodku myszy (organizmu modelowego w badaniach nad biologią rozwoju ssaków) komórek stricte zarodkowych, z których w dalszym rozwoju wytwarza się nowy osobnik, a także zdolnych do wykształcenia zarodkowych komórek macierzystych (ICM), oraz komórek pozazarodkowych, tworzących TE. Pozwolą także odpowiedzieć na pytanie, czy o losie blastomerów decyduje tylko ich położenie w zarodku (wewnętrzne lub zewnętrzne), czy też może w pewnym stopniu jest on predeterminowany przez różnice pomiędzy blastomerami zarodka 8-komórkowego. Spodziewamy się uzyskać także odpowiedź na pytanie, czy o różnicowaniu komórek ICM na EPI i PE decyduje wyłącznie ich położenie wewnątrz lub na powierzchni ICM, czy też te dwie warstwy wyodrębniają się w wyniku różnic, które występują już wcześniej pomiędzy komórkami ICM.
Projekt realizowany jest od jesieni 2009. Podczas badań prowadzonych w ramach tego projektu powstały dotychczas dwie prace licencjackie i pięć prac magisterskich.
Metodyka badawcza
- określanie ekspresji genów - metoda RT real-time PCR
Z zarodków lub pojedynczych blastomerów izolowane jest mRNA. Po przeprowadzeniu reakcji odwrotnej transkrypcji (RT), powstałe cDNA użyte jest w reakcji PCR w czasie rzeczywistym (real-time PCR).
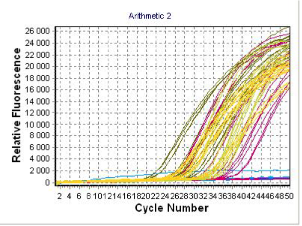 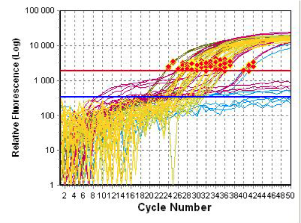 | Krzywe przedstawiają wzrost ilości produktów PCR w poszczególnych próbkach w kolejnych cyklach reakcji |
Poziom mRNA oblicza się według uzyskanego Ct (wartość progowa), oznaczającym liczbę cykli, po których rozpoczyna się faza wzrostu wykładniczego reakcji PCR
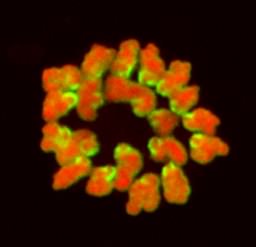
- badanie lokalizacji białek – metoda immunofluorescencji pośredniej
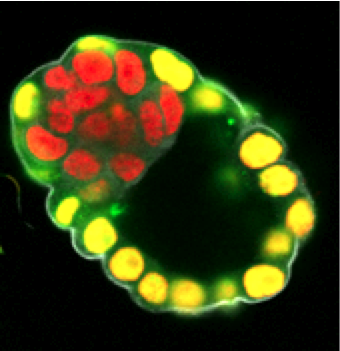 | Stosowane są przeciwciała I-rzędowe (skierowane na badane białko) i przeciwciała II-rzędowe sprzężone z odpowiednim fluorochromem (np. TRITC, FITC). Analizę przeprowadza się za pomocą mikroskopu konfokalnego. |
Przykład - lokalizacja białka Cdx2 (kolor żółty) w blastocyście myszy.
- dezagregacja zarodków
Zarodki w różnym stadium rozwoju można dezagregować na pojedyncze blastomery, które są hodowane in vitro.
Przykład – dezagregacja zarodka 8-komórkowego
Mechanizmy odpowiedzialne za powstawanie epiblastu i hipoblastu w przedimplantacyjnym zarodku myszy
Kierownik projektu: dr hab. Aneta Suwińska
Projekt jest realizowany w ramach programu POMOST Fundacji na rzecz Nauki Polskiej, współfinansowanego przez Unię Europejską; Program Operacyjny Innowacyjna Gospodarka 2007 – 2013. Czas realizacji projektu: 2010-2013.
Obszerne omówienie projektu znajduje się na osobnej stronie: Mechanizmy odpowiedzialne za powstawanie epiblastu i hipoblastu w przedimplantacyjnym zarodku myszy
Wpływ starzenia poowulacyjnego na potencjał rozwojowy zarodków ssaczych / Regulacja dynamiki fazy M pierwszego podziału zarodkowego ssaków
Kierownik badań: dr hab. Anna Ajduk
Historia
Do poświęconego embriologii w Polsce specjalnego numeru International Journal of Developmental Biology napisaliśmy artykuł dość wyczerpująco omawiający (między innymi) badania prowadzone w Zakładzie Embriologii UW:
Można zapoznać się z pełną listą naszych publikacji.
Zachowaliśmy slajdy z prezentacji naszego zakładu na Wydziale Biologii (2005).