Mechanizmy odpowiedzialne za powstawanie epiblastu i hipoblastu w przedimplantacyjnym zarodku myszy
Projekt realizowany w ramach programu POMOST Fundacji na rzecz Nauki Polskiej, współfinansowanego przez Unię Europejską (Program Operacyjny Innowacyjna Gospodarka 2007–2013). Czas realizacji projektu: 2010-2013.
Kierownik projektu: dr Aneta Suwińska
Stypendyści:
- Katarzyna Filimonow — doktorantka;
- Magdalena Krupa — doktorantka;
- Katarzyna Świtoń — magistrantka
Wprowadzenie i cel projektu
W okresie okołoimplantacyjnym zarodek myszy ma postać pęcherzyka z jamką wypełnioną płynem i nosi nazwę blastocysty. Blastocysta składa się z trzech pierwotnych linii komórkowych, które powstają w wyniku dwóch rund różnicowania. W pierwszym etapie tworzy się trofektoderma — warstwa komórek zewnętrznych, która będzie odpowiedzialna za implantację w ścianie macicy, a potem wejdzie w skład łożyska oraz węzeł zarodkowy — grupa komórek wewnętrznych, z których powstaną wszystkie tkanki zarodka oraz większość błon płodowych. Tuż przed implantacją zachodzi druga fala różnicowania, która prowadzi do wyodrębnienia w węźle zarodkowym epiblastu, oraz drugiej po trofektodermie linii pozazarodkowej — hipoblastu. Hipoblast jest warstwą komórek leżących na wewnętrznej powierzchni węzła zarodkowego (od strony jamki blastocysty), z której po implantacji powstanie endoderma pęcherzyka żółtkowego. Epiblast znajduje się wewnątrz węzła zarodkowego i da początek wszystkim komórkom zarodka, zarówno somatycznym, jak i komórkom linii płciowej.
Blastocysta składająca się z trzech linii komórkowych: trofektodermy, epiblastu i hipoblastu (zdjęcie z mikroskopu konfokalnego — wybarwiono fluorescencyjnie białka charakterystyczne dla poszczególnych linii komórkowych: Cdx2, Oct4 i Gata4; autor: M. Krupa)
Węzeł zarodkowy, a potem epiblast należą do tych linii komórkowych, które przejściowo zachowują pluripotencję. Hodując komórki węzła zarodkowego lub epiblastu in vitro w pożywce wzbogaconej czynnikiem LIF zapobiegającym różnicowaniu, można z nich uzyskać linie zarodkowych komórek macierzystych — komórek ES. Zarodkowe komórki macierzyste charakteryzują się zdolnością samoodnowy oraz są pluripotentne, czyli zdolne do różnicowania we wszystkie rodzaje komórek dorosłego organizmu.
Kolonie komórek ES rosnące in vitro na warstwie mysich fibroblastów zarodkowych (MEF)
Kolonie komórek ES (zdjęcie z mikroskopu konfokalnego — zabarwione jądra komórkowe, białko powierzchniowe SSEA1 oraz marker pluripotencji — białko Oct4; autor: M. Krupa)
Usunięcie czynnika LIF hamującego różnicowanie indukuje agregację komórek ES i formowanie struktur zwanych kulami zarodkowymi. Wydarzenia towarzyszące różnicowaniu się komórek budujących kule zarodkowe przypominają kolejne etapy różnicowania zachodzące podczas normalnej embriogenezy. Z tego względu kule zarodkowe wykorzystywane są jako wygodny model w badaniach nad okołoimplantacyjnym zarodkiem.
Kula zarodkowa powstała w wyniku agregacji komórek ES (zdjęcie z mikroskopu konfokalnego — zabarwione jądra komórkowe i marker pluripotencji — białko Oct4; autor: M. Krupa)
Mechanizmy komórkowe i molekularne odpowiedzialne za powstanie dwóch populacji komórek w węźle zarodkowym (epiblastu i hipoblastu) nie zostały do końca poznane. Istnieją dwie hipotezy wyjaśniające ten proces. Pierwsza z nich zakłada, że węzeł zarodkowy we wczesnej blastocyście jest homogenną populacją równocennych, niezdeterminowanych komórek, mających zdolność przekształcenia się zarówno w komórki hipoblastu, jak i epiblastu. Czynnikiem determinującym los komórek byłaby w tym wypadku ich pozycja w węźle zarodkowym. Drugi model zakłada, że węzeł zarodkowy stanowi heterogenną populację komórek, które już na etapie wczesnej blastocysty są zdeterminowane do utworzenia epiblastu bądź pierwotnej endodermy. O kierunku różnicowania decydowałaby ekspresja specyficznych dla każdej z linii czynników transkrypcyjnych, zaś ułożenie poszczególnych komórek w węźle zarodkowym i powstawanie odrębnych warstw epiblastu i hipoblastu w późnej blastocyście byłoby rezultatem ich przemieszczania i segregacji. Za segregację komórek do dwóch odrębnych warstw w późnej blastocyście odpowiadałyby różne właściwości adhezyjne obu rodzajów komórek, ich migracja oraz wybiórcza apoptoza.
Celem projektu jest zgłębienie mechanizmów regulujących powstawanie epiblastu i hipoblastu w przedimplantacyjnym zarodku myszy. Planowane badania mają dać odpowiedź na pytanie, w którym momencie rozwoju następuje determinacja losów komórek tworzących obie linie komórkowe i które czynniki (pozycja w zarodku, pochodzenie, obecność specyficznych czynników transkrypcyjnych czy szczególne właściwości adhezyjne) są odpowiedzialne za ten proces.
Obiektem w naszych badaniach są przedimplantacyjne zarodki myszy oraz zarodkowe komórki macierzyste.
Metody badawcze
Z użyciem zarodków: dezagregacja zarodków na pojedyncze komórki, badanie ekspresji genów metodą Real-Time PCR, tworzenie chimer za pomocą agregacji komórek zarodków lub mikroiniekcji komórek ES do zarodków przedimplantacyjnych, śledzenie metodą immunofluorescencji pośredniej losów wprowadzanych komórek, transplantacja zarodków do dróg rodnych samic biorczyń.
Z użyciem zarodkowych komórek macierzystych (ES): hodowla, różnicowanie w kule zarodkowe, wpływ wyciszania ekspresji specyficznych genów (metodą siRNA) na proces różnicowania.
Efekt dezagregacji 16-komórkowego zarodka (komórki zewnętrzne wyznakowane fluorescencyjnymi mikrokuleczkami lateksowymi, pobranymi przez zarodek w wyniku endocytozy)
Tworzenie zarodka chimerowego metodą agregacji pojedynczej komórki 2N (diploidalnej) z 16-komórkowego zarodka (GFP+) z czterema komórkami 4N (tetraploidalnymi) z zarodka 4-komórkowego. Świecące na zielono w mikroskopie fluorescencyjnym GFP (green fluorescent protein — białko zielonej fluorescencji) pozwala śledzić los komórek i ich potomstwa.
Chimerowa blastocysta powstała w wyniku agregacji pojedynczej komórki z 8-komórkowego zarodka (GFP+) z 8 komórkami z 8-komórkowego zarodka (GFP-)
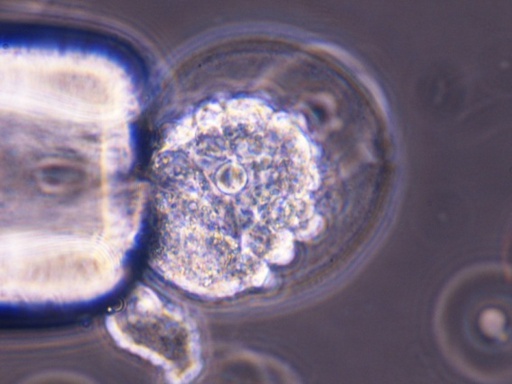
Mikroiniekcja komórek ES (GFP+) do blastocysty — z lewej widoczna pipeta przytrzymująca blastocystę w osłonce przejrzystej, z prawej blastocysta po wstrzyknięciu komórki.
Komórka ES (GFP+) osiadła po mikroiniekcji w węźle zarodkowym blastocysty
Kolonia komórek ES (GFP+) w rozroście blastocysty uzyskana po wstrzyknięciu pojedynczej komórki ES do blastocysty (dodatkowo zabarwione jądra komórkowe oraz Gata4 — marker hipoblastu)


